シャーペンの芯が電極に!「塩化銅の電気分解」で化学変化を追跡しよう(マイクロスケール実験でエコに!)
サイエンストレーナーの桑子研です。毎日が実験。
皆さん、理科の実験と聞くと、何を思い浮かべますか? ビーカーやフラスコが並び、なんだか難しそうな薬品をたくさん使う…そんなイメージかもしれません。でも実は、もっと手軽に、そして環境にも優しく科学の核心に迫る方法があるんです。
今回は、中学校の理科でもおなじみの「塩化銅の電気分解」を、驚くほど小さな実験器具( #マイクロプレート )を使って行う「 #マイクロスケール実験 」でご紹介します。この実験、ただ電気を流すだけじゃないんです。青く美しい水溶液が「透明」に変わり、見えなかったはずの「金属」が現れる…。まるで魔法のような化学変化を、目の前で観察できますよ!
小さな実験室「マイクロスケール」の魅力
今回行った「 #マイクロスケール実験 」は、私が以前勤めていた学校でも取り入れていた方法です。 使う薬品や水の量を最小限に抑えるため、実験後に出る「廃液(はいえき)」を劇的に減らすことができます。環境に配慮しながら、準備や片付けも簡単になり、安全に実験が楽しめるのが最大の魅力です。
小さなスケールだからこそ、変化が素早く現れることもあり、観察にもぴったりなんですよ。マイクロスケール実験についてもっと知りたい方は、こちらの論文をぜひチェックしてみてください。実験の詳細や、塩化銅水溶液の作り方についても丁寧にまとめられています。
マイクロスケール実験については、詳しくこちらの論文で詳しくまとめられています
こちらが実際の実験の様子です。まずは動画でご覧ください!
実験の準備と「なるほど!」な工夫
実験に使う「塩化銅水溶液」は、青い色をした液体です。 理科の実験では、薬品の濃度(こさ)を正確に計算して準備します。
【10%-塩化銅(Ⅱ)二水和物水溶液の調製法】
塩化銅(Ⅱ)二水和物 CuCl2・2H2O 式量=170.48
10%水溶液を調製する場合,水和水を除いて10gになる量をはかりとる。 CuCl2=63.5+35×2=133.5 2H2O=2×18=36 であるから,
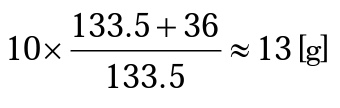
よって,13gの塩化銅(Ⅱ)二水和物結晶に水を加えて100gにする。
少し専門的な計算が出てきましたが、これは水溶液に「水和水(結晶に含まれる水)」がある場合に必要な計算ですね。ただ、嬉しいことに、今回の実験の塩化銅の濃度は、低めでも可能です(3パーセントでも大丈夫です)。その場合は、13gの塩化銅(Ⅱ)二水和物結晶に水を加えて300gにすれば大体3%くらいとなります。
論文ではひとつのセル(実験の穴)に4cm3とありますが、比較のために1cm3も用意しました。
ちなみに、仮に学校で4人班×10班(40人クラス)で実験するとしても、1班分(4cm3)×10=40cm3。4クラス全体でもたった160cm3(牛乳パックの1/6程度)で済んでしまいます。本当にエコですよね!



(今回は比較実験もしたかったので、多めに作っています)

実験方法と安全の工夫
実験方法はシンプルです。
- セルに塩化銅(Ⅱ)二水和物水溶液を入れる。実験用に4mL 色の比較用に隣のプレートに1mL入れましょう。
- 炭素棒電極を挿入し,5V直流電圧を印加する。3分程度です。
- 陽極(+極),陰極(-極)での変化を観察する。
- 陽極・陰極から発生したものについて調べる。
ここで面白い工夫があります。電極に使う「炭素棒」ですが、なんと「太い2mmの芯のシャーペンの芯」で代用できてしまうんです!

|
|
シャーペンの芯も、鉛筆の芯と同じ「炭素」でできており、電気をよく通すんですね。
ただし、ここで重要なのが「ショート防止」です。+極と-極が水溶液の中でくっついてしまうと、電気が水溶液ではなく電極同士を直接流れてしまい(ショート)、正しく電気分解ができません。非常に危険です。そこで、発泡スチロールを小さくカットして電極を固定する台座を作りました。


発泡スチロールがなくても、電極を「八の字」に開いて、絶対にくっつけないように強く注意することも大切です。

八の字がポイント
回路はこんな風に、1つの電源装置から分岐させて、2つの実験を同時に行えるようにしました。電圧は5Vです。

ミニ電源装置(Petit-X)を使うとこんなに片付いた状態で実験もできます。

いざ実験!青い水溶液が大変身
電極をとりつけて、電気分解をスタート!

じっと溶液を観察していると…さっそく変化が現れました。陰極(-極)の方に、何か茶色っぽい物質がまとわりついていくのがわかります。そして陽極(+極)の方からは、細かな泡がプツプツと発生し始めました。


さらに10分間くらい電圧をかけ続けると…あれほど鮮やかだった水溶液の青色が、すっかり消えて透明になりました!(※時間を短縮したい場合は9Vくらいで行うこともできますが、ショートには一層の注意が必要です!)
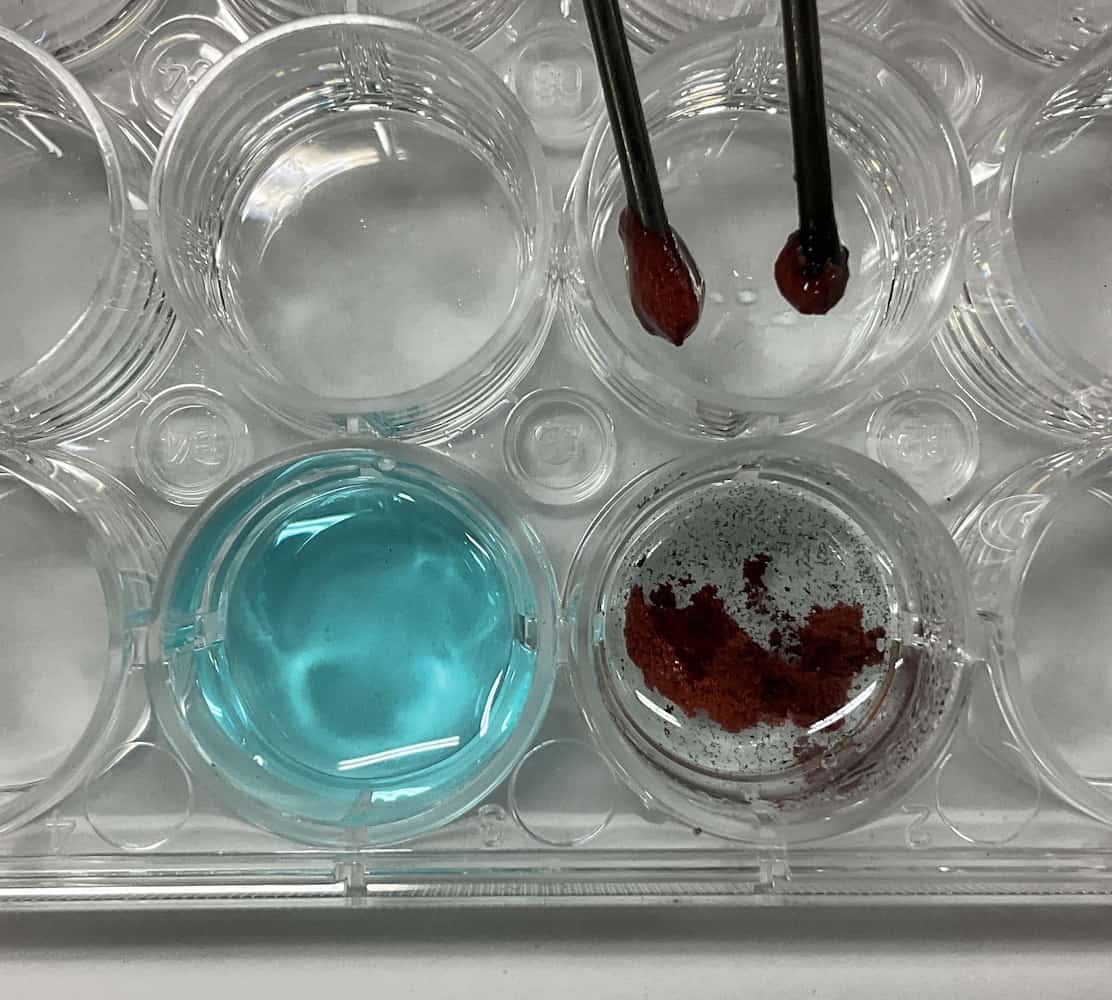
謎解き編:消えた「青」と現れた「泡」の正体
さて、この不思議な変化の正体を突き止めましょう。まず、水溶液の「青色」の正体は、「銅イオン(Cu2+)」という粒子です。塩化銅(CuCl2)が水に溶けると、銅イオン(Cu2+)と塩化物イオン(Cl–)に分かれます。
【陰極(-極)での変化】
陰極(-極)には、プラスの電気を持つ「銅イオン(Cu2+)」が引き寄せられます。そして、電源から送られてきた電子(e–)を受け取り、電気的に中性な「銅(Cu)」の原子になります。これが、電極に付着した茶色い物質の正体です!水溶液から青色の「銅イオン」がどんどん「銅」に変わっていったため、水溶液の色が消えて透明になった、というわけです。
検証方法として、実際に叩いてみて光沢や展性を見ることがあります。

また炎色反応がありますね。濾紙に塩化銅水溶液を染み込ませて行う方法が安全です。こちらの動画をご覧ください。
【陽極(+極)での変化】
陽極(+極)には、マイナスの電気を持つ「塩化物イオン(Cl–)」が引き寄せられます。そして、電子(e–)を奪われて「塩素(Cl2)」という気体(ガス)になります。あのプツプツとした泡の正体は、プールの消毒の匂いでおなじみの「塩素」だったのです!
塩素には「脱色作用(だっしょくさよう)」といって、色を消す(漂白する)働きがあります。生徒たちには、この塩素の確認を自由に試してもらいました。ろ紙に水性インク(赤)をたらして、それを陽極の近くに置いて脱色反応を確かめる班、ろ紙を溶液に浸してみる班、隣のセルに水とインクを入れて泡を誘導する班など、様々です。


水性のインクの他に、緑色の蛍光ペンを使うと、色の変化がとても見やすいこともわかりました!これも面白い発見です。

広がる科学のつながり
実験はこれで終わりではありません。陰極(-極)に付着した「銅」は、ろ紙の上に取り出してスプーンなどでこすると、ピカピカの金属光沢を放つのも確認できます。さらに、ある班はガスバーナーを使って、水溶液や付着した銅を燃やし、「炎色反応(えんしょくはんのう)」を確かめていました。
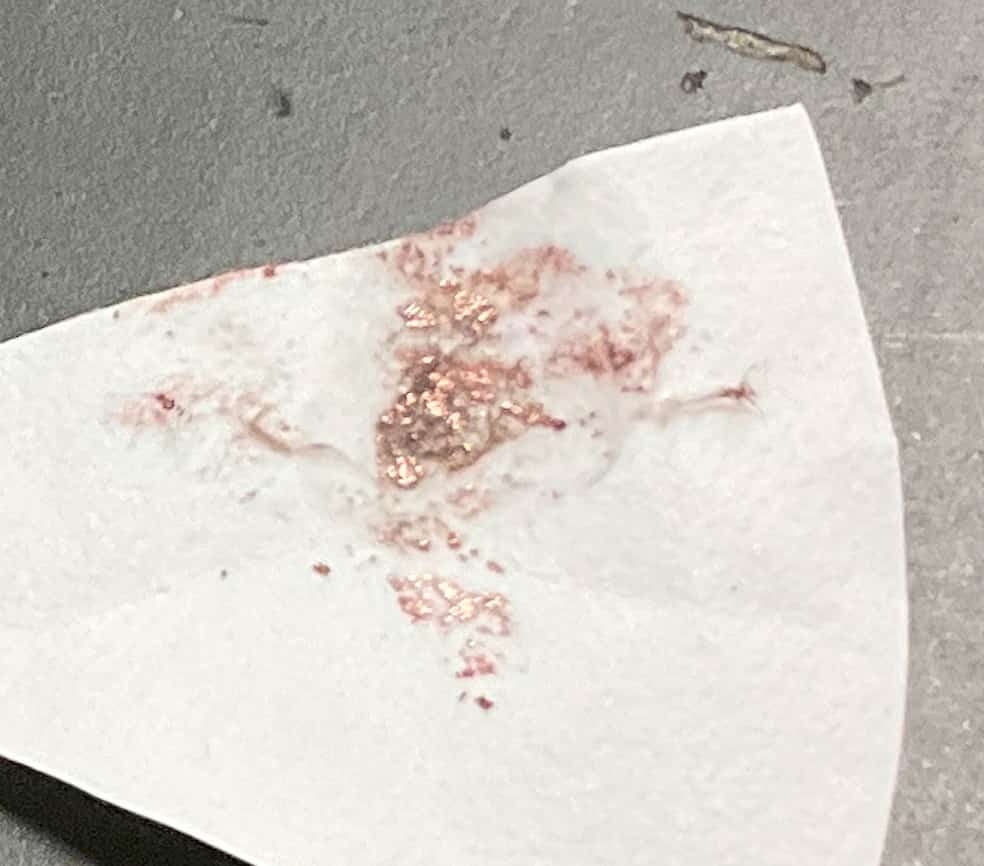
銅は炎に入れると青緑色の炎を上げます。これは花火の色付けにも使われている原理です。自分たちで取り出した物質が、確かに「銅」であることを、色々な方法で確かめていく…まさに科学の醍醐味(だいごみ)ですね。「電気分解」という言葉だけを覚えるのではなく、実際に目の前で物質が変わり、色が消え、新しい物質が生まれる瞬間を体験することで、化学の面白さがグッと深まります。いろいろな発見のある、本当に面白い実験です。マイクロスケール実験については、こちらの本も買ってみました。
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください! ・運営者・桑子研についてはこちら ・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら ・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c4b1d07.ce019e28.2c4b1d08.6132124d/?me_id=1208593&item_id=10346879&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Farde%2Fcabinet%2Fitem654%2F5312487_1.jpg%3F_ex%3D240x240&s=240x240&t=picttext)



